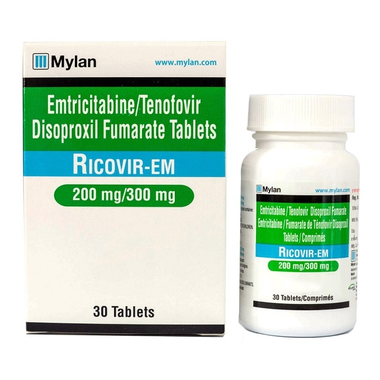
Thuốc Ricovir-Em 200mg/300mg Mylan điều trị HIV (30 viên)
Mô tả tóm tắt

Sản phẩm liên quan
Sản phẩm tương tự
-
Thuốc trị nhiễm khuẩn
Dopharalgic 500mg – Thuốc điều trị nhiễm khuẩn hiệu quả
Dược phẩm Eunice Hà Nội
Được xếp hạng 0 5 sao570.000 ₫ Mua hàng -
Giảm đau, hạ sốt, chống viêm
Paracetamol 500 mg viên nén màu trắng – Giảm đau, hạ sốt
Nhà thuốc Ngọc Thu Biên Hòa - Đồng Nai
Được xếp hạng 4.00 5 sao54.000 ₫ Mua hàng
Mô tả chi tiết
Thuốc Ricovir-Em 200mg/300mg
Thành phần
-Emtricitabine 200mg
-Tenofovir Disoproxil Fumarat 300mg
Tá dược: Cellulose vi tinh thể, Natri Croscarmellose, Lactose Monohydrat, Magnesium Stearat, Opadry Blue.
Công dụng
Chỉ định
Thuốc Ricovir Em được chỉ định dùng trong các trường hợp sau:
Trong liệu pháp kết hợp thuốc kháng retrovirus cho người lớn bị nhiễm HIV – 1 và phối hợp với các thuốc kháng virus khác theo hướng dẫn của Bộ Y Tế.
Sự khẳng định lợi ích của thuốc phối hợp entricitabine và tenofovir disoproxil fumarate trong điều trị kháng retrovirus dựa chủ yếu vào các nghiên cứu thực hiện trên bệnh nhân chưa từng điều trị trước đó.
Dược lực học
Emtricitabine là một đồng đẳng nucleoside thuộc nhóm cytidine. Trong cơ thể, tenofovir disoproxil fumarate được chuyển thành tenofovir, một đồng đẳng nucleoside monophosphat (nucleotide) của adenosine monophosphat. Cả emtricitabine và tenofovir đều có hoạt tính đặc hiệu đối với virus gây suy giảm miễn dịch ở người (HIV – 1 và HIV – 2) và virus viêm gan B.
Emtricitabine và tenofovir được phosphoryl hóa bởi các enzyme trong tế bào để tạo thành emtricitabine triphosphat và tenofovir diphosphat, tương ứng. Các nghiên cứu in vitro chỉ ra rằng cả emtricitabine và tenofovir đều có thể bị phosphoryl hóa hoàn toàn khi dùng kết hợp với nhau trong tế bào.
Entricitabine triphosphat và tenofovir diphosphat ức chế cạnh tranh men sao chép ngược HIV – 1, làm kết thúc chuỗi DNA. Cả entricitabine triphosphat và tenofovir diphosphat đều là chất ức chế yếu đối với polymerase DNA của động vật có vú và không có dấu hiệu độc tính đối với ty thể cả in vitro và in viνο.
Dược động học
Hấp thu
Tương đương sinh học của viên nén bao phim kết hợp liều cố định emtricitabine và tenofovir disoproxil fumarate so với một viên nang cứng entricitabine 200mg và một viên bao phim tenofovir disoproxil fumarate 245mg đã được xác lập sau khi cho người tình nguyện khỏe mạnh dùng liều duy nhất lúc đói.
Sau khi cho người tình nguyện khỏe mạnh uống viên kết hợp liều cố định entricitabine và tenofovir disoproxil fumarate, emtricitabine và tenofovir disoproxil fumarate được hấp thu nhanh chóng và tenofovir disoproxil fumarate được chuyển thành tenofovir.
Nồng độ entricitabine và tenofovir tối đa đạt được trong huyết thanh từ 0,5 tới 3 giờ sau khi uống trong tình trạng đói. Uống viên kết hợp liều cố định intricitabine và tenofovir disoproxil fumarate với thức ăn làm chậm thời gian để đạt được nồng độ tối đa của tenofovir khoảng 45 phút và làm tăng AUC và Cmax của tenofovir tương ứng khoảng 35% và 15%, khi dùng kèm với bữa ăn nhẹ hoặc nhiều béo, so với uống thuốc lúc đói. Để tối ưu hóa sự hấp thu tenofovir, người ta khuyên rằng nên uống viên kết hợp với thức ăn.
Phân bố
Sau khi truyền tĩnh mạch, thể tích phân bố của emtricitabine và tenofovir tương ứng là khoảng 1,4l/kg và 800ml/kg. Sau khi uống entricitabine hoặc tenofovir disoproxil fumarate, entricitabine và tenofovir được phân bố rộng rãi trên khắp cơ thể.
Trên in vitro, tỷ lệ emtricitabine gắn kết với protein huyết tương người < 4% và độc lập với nồng độ trong khoảng 0,02 đến 200µg/ml. Trên in vitro, tỷ lệ tenofovir gắn kết với protein huyết tương hoặc huyết thanh tương ứng là dưới 0,7 và 7,2%, trong khoảng nồng độ tenofovir từ 0,01 – 25µg/ml.
Chuyển dạng sinh học
Hiểu biết về quá trình chuyển hoá của emtricitabin còn hạn chế. Chuyển dạng sinh học của entricitabin bao gồm quá trình oxy hoá nhóm thiol tạo thành đồng phân lập thể 3’-sulphoxide (khoảng 9% liều) và liên kết với glucturonic acid để tạo thành 2 – O – glucuronid (khoảng 4% liều).
Các nghiên cứu in vitro đã khẳng định rằng cả tenofovir disoproxil funnarate lẫn tenofovir đều không là cơ chất của hệ enzym CYP450. Trong quá trình chuyển dạng sinh học, cả entricitabine và tenofovir đều không ức chế quá trình chuyển hoá các thuốc trung gian qua bất kỳ đồng dạng nào của CYP450 người. Đồng thời entricitabine cũng không ức chế uridine 5′ – diphosphoglucuronyl transferase, là enzyme của quá trình glucuronid hoá.
Thải trừ
Entricitabine được thải trừ chủ yếu qua thận, 86% trong nước tiểu, qua phần (khoảng 14%). 13% liều entricitabine trong nước tiểu là ba chất chuyển hoá. Độ thanh thải của emtricitabine trung bình là 327ml/phút. Sau khi uống, thời gian bán thải của entricitabine khoảng 10 giờ.
Tenofovir được thải trừ chủ yếu qua thận bằng cả con đường lọc ở cầu thận và qua hệ thống vận chuyển chủ động ở ống thận, khoảng 70 – 80% liều truyền tĩnh mạch được bài tiết qua nước tiểu dưới dạng không đổi. Độ thanh thải của tenofovir trung bình là 307ml/phút.
Độ thanh thải của thận ước tính là khoảng 210ml/phút, tốc độ thanh thải của tenofovir cao hơn nhiều so với tốc độ lọc ở cầu thận. Điều này chỉ ra rằng bài tiết chủ động qua ống thận đóng vai trò quan trọng trong quá trình thải trừ tenofovir. Thời gian bán thải của tenofovir sau khi uống là khoảng 12 – 18 giờ.
Cách dùng
Thuốc dùng đường uống. Nếu bệnh nhân khó nuốt, có thể phân tán viên kết hợp trong khoảng 100ml nước cam hoặc nước nho và uống ngay sau khi pha.
Liều dùng:
Người lớn
Liều khuyến cáo là một viên, uống ngày một lần.
Trẻ em và vị thành niên
Không nên dùng viên kết hợp cho trẻ em và thiếu niên.
Người già
Không cần phải hiệu chỉnh liều nếu không có bằng chứng của tình trạng suy thận.
Suy chức năng thận
Cần phải hiệu chỉnh liều.
Suy gan
Không cần phải hiệu chỉnh liều.
Lưu ý: Liều dùng trên chỉ mang tính chất tham khảo. Liều dùng cụ thể tùy thuộc vào thể trạng và mức độ diễn tiến của bệnh. Để có liều dùng phù hợp, bạn cần tham khảo ý kiến bác sĩ hoặc chuyên viên y tế.
Làm gì khi dùng quá liều?
Nếu xảy ra quá liều, bệnh nhân phải được giám sát chặt chẽ về các dấu hiệu ngộ độc và được áp dụng các biện pháp hỗ trợ tiêu chuẩn khi cần thiết. Tới 30% liều emtricitabine và khoảng 10% liều tenofovir có thể loại bỏ bằng cách thẩm tách máu. Hiện còn chưa biết có thể loại bỏ emtricitabine hoặc tenofovir bằng thẩm phân phúc mạc hay không.
Làm gì khi quên 1 liều?
Nếu bạn quên một liều thuốc, hãy dùng càng sớm càng tốt ngay khi nhớ ra. Tuy nhiên, nếu gần với liều kế tiếp, hãy bỏ qua liều đã quên và dùng liều kế tiếp vào thời điểm như kế hoạch. Lưu ý rằng không nên dùng gấp đôi liều đã quy định.
Tác dụng phụ
Khi sử dụng thuốc Ricovir EM, bạn có thể gặp các tác dụng không mong muốn (ADR).
Các rối loạn về hệ máu và bạch huyết
Hay gặp: Giảm bạch cầu trung tính.
Các rối loạn ở hệ miễn dịch
Hay gặp: Phản ứng dị ứng.
Các rối loạn về chuyển hóa và dinh dưỡng
Rất hay gặp: Hạ phosphat máu.
Hay gặp: Tăng triglycerid máu, tăng đường máu.
Hiếm gặp: Nhiễm acid lactic, nhiễm acid lactic thường kèm theo gan nhiễm mỡ, đã được báo cáo trong quá trình sử dụng các thuốc tương tự nucleoside.
Các rối loạn tâm thần
Thường gặp: Giấc mơ bất thường, mất ngủ.
Các rối loạn hệ thần kinh
Rất hay gặp: Chóng mặt, đau đầu.
Các rối loạn hệ hô hấp, ngực, và trung thất
Rất hiếm gặp: Khó thở.
Các rối loạn ở dạ dày ruột
Rất hay gặp: Tiêu chảy, buồn nôn, nôn.
Hay gặp: Đầy hơi, khó tiêu, đau bụng, lipase huyết thanh tăng, amylase tăng bao gồ của tuyến tụy.
Hiếm gặp: Viêm tụy.
Các rối loạn ở gan mật
Hay gặp: Tăng bilirubin máu, tăng transaminase.
Rất hiếm gặp: Viêm gan.
Các rối loạn ở da và mô dưới da
Hay gặp: Nổi ban, ngứa, ban dát – sần, mày đay, ban rộp, ban mủ, và biến màu da (tăng sắc tố).
Các rối loạn cơ khớp và mô liên kết
Rất hay gặp: Tăng creatine kinase.
Các rối loạn thần và tiết niệu
Hiếm gặp: Suy thận (cấp và mãn), bệnh lý đầu ống thận bao gồm hội chứng fanconi, protein niệu, tăng creatinine.
Các rối loạn toàn thân và tại nơi dùng thuốc
Hay gặp: Đau, suy nhược.
Ngoài ra, thiếu máu là hay gặp và biến màu da (tăng sắc tố) là rất hay gặp khi dùng emtricitabine cho bệnh nhân nhi.
Các ghi chép về phản ứng ngoại ý ở bệnh nhân bị nhiễm đồng thời HIV/HBV hoặc HIV/HCV cũng tương tự như bệnh nhân chỉ nhiễm HIV. Tuy nhiên, đối với nhóm bệnh nhân này, sự tăng AST và ALT xuất hiện thường xuyên hơn so với nhóm bệnh nhân nhiễm HIV nói chung.
Liệu pháp kháng retrovirus kết hợp thường kèm theo các bất thường chuyển hóa như tăng triglycerid máu, tăng cholesterol máu, đề kháng insulin, tăng đường máu và tăng lactat máu.
Liệu pháp kháng retrovirus kết hợp cũng kèm theo tái phân bố mỡ trên cơ thể (loạn dưỡng mỡ) bệnh nhân HIV bao gồm mất mỡ ngoại vi và mỡ dưới da mặt, tăng mỡ bụng và nội tạng, phù đại ngực và tích mỡ vùng cổ lưng (bướu trâu).
Những bệnh nhân nhiễm bị suy giảm miễn dịch nặng ở thời điểm bắt đầu liệu pháp kháng retrovirus kết hợp (CART), có thể xảy ra phản ứng viêm với sự xâm nhiễm không có triệu chứng hoặc cơ hội sót lại.
Những trường hợp hoại tử xương đã được báo cáo, đặc biệt ở những bệnh nhân có những nhân tố nguy cơ đã được nhận biết tổng quát, bệnh HIV cấp tiến hoặc điều trị lâu dài với liệu pháp kháng retrovirus kết hợp (CART). Tần số của trường hợp này vẫn chưa được biết.
Hướng dẫn cách xử trí ADR
Khi gặp tác dụng phụ của thuốc, cần ngưng sử dụng và thông báo cho bác sĩ hoặc đến cơ sở y tế gần nhất để được xử trí kịp thời.
Lưu ý
Trước khi sử dụng thuốc bạn cần đọc kỹ hướng dẫn sử dụng và tham khảo thông tin bên dưới.
Chống chỉ định
Thuốc Ricovir Em chống chỉ định trong các trường hợp sau:
Quá mẫn với entricitabine, tenofovir, tenofovir disoproxil fumarate hoặc bất cứ thành phần nào của thuốc.
Thận trọng khi sử dụng
Không nên dùng viên kết hợp đồng thời với các thuốc khác có chứa entricitabine, tenofovir disoproxil (dưới dạng fumarate) hoặc các đồng đẳng cytidine khác, như lamivudine và zalcitabine.
Không nên dùng viên kết hợp này với bệnh nhân suy thận có độ thanh thải creatinine <30ml/phút hoặc bệnh nhân cần thẩm tách máu. Cần hiệu chỉnh liều với bệnh nhân suy thận.
Cần lưu ý khi dùng thuốc với các trường hợp:
Bệnh nhân nhiễm đồng thời HIV và virus viêm gan B hoặc viêm gan C.
Bệnh gan.
Nhiểm acid lactic.
Cần theo dõi các bệnh nhân có nguy cơ cao:
Loạn dưỡng mỡ.
Rối loạn chức năng ty thể.
Khả năng lái xe và vận hành máy móc
Không có nghiên cứu nào về ảnh hưởng của viên kết hợp liều cố định entricitabine và tenofovir disoproxil fumarate. Tuy nhiên, bệnh nhân cần được thông báo rằng đã có báo cáo về tình trạng chóng mặt trong quá trình điều trị bằng emtricitabine cũng như bằng tenofovir disoproxil fumarate.
Thời kỳ mang thai
Đối với entricitabine và tenofovir disoproxil fumarate, tác hại của thuốc trên phụ nữ mang thai không đầy đủ. Các nghiên cứu trên động vật không cho thấy tác hại trực tiếp hoặc gián tiếp của emtricitabin hoặc tenofovir disoproxil fumarate về khía cạnh thai nghén, sự phát triển của phối/bào thai, quá trình sinh nở hoặc sự phát triển sau khi ra đời.
Tuy nhiên, chỉ nên dùng viên kết hợp trong quá trình mang thai khi không có lựa chọn nào khác phù hợp hơn. Khi dùng viên kết hợp phải đồng thời sử dụng một biện pháp tránh thai hiệu quả.
Thời kỳ cho con bú
Hiện còn chưa biết liệu entricitabine hoặc tenofovir có được bài tiết qua sữa mẹ hay không. Phụ nữ nhiễm HIV được khuyên rằng không nên nuôi con bằng sữa của mình trong bất kỳ trường hợp nào để tránh lây truyền HIV cho con.
Tương tác thuốc
Dược động học ở trạng thái ổn định của entricitabine và tenofovir không bị ảnh hưởng khi entricitabine và tenofovir disoproxil fumarate được dùng kết hợp với nhau so với khi dùng riêng từng thuốc. Các nghiên cứu tương tác dược động học trên lâm sàng và in vitro đã cho thấy ít có khả năng xảy ra các tương tác có trung gian là CYP450 liên quan tới emtricitabine và tenofovir disoproxil fumarate với các thuốc khác.
Các tương tác liên quan đến entricitabine
Việc dùng kết hợp với các thuốc cũng được bài tiết chủ động ở ống thận có thể dẫn tới tăng nồng độ của cả emtricitabine và thuốc kết hợp do sự cạnh tranh đường thải trừ này. Không có kinh nghiệm lâm sàng về việc sử dụng kết hợp emtricitabine với các chất đồng đẳng cytidine. Do đó, không nên dùng kết hợp entricitabine với lamivudine hoặc zalcitabine để điều trị nhiễm HIV.
Các tương tác liên quan tới tenofovir
Khi tenofovir disoproxil fumarate được phối hợp với lopinavir/ritonavir, không có biến đổi nào về dược động học của lopinavir và ritonavir, AUC của tenofovir tăng lên khoảng 30% khi tenofovir disoproxil fumarate được phối hợp với lopinavir/ritonavir.
Khi dùng didanosine dưới dạng viên nang tan trong ruột 2 giờ trước khi dùng tenofovir disoproxil fumarate hoặc cùng một lúc, AUC của midanosine tăng tương ứng trung bình là 48% và 60%. Mức tăng trung bình giá trị AUC của didanosine là 44% khi dùng viên nén có chất đệm 1 giờ trước khi dùng tenofovir. Trong cả hai trường hợp các chỉ số dược động học của tenofovir được dùng kèm theo một bữa ăn nhẹ là không thay đổi. Không nên dùng phối hợp tenofovir disoproxil fumarate với didanosine.
Khi tenofovir disoproxil fumarate được dùng phối hợp với atanazavir, nồng độ atanazavir giảm (mức giảm tương ứng của AỤC và Cmin là 25% và 40% so với atanazavir 400mg). Khi dùng thêm ritonavir với atanazavir, ảnh hưởng tiêu cực của tenofovir lên Cmin của atanazavir đã giảm đi rõ rệt, trong khi mức giảm của AUC vẫn giữ nguyên (mức giảm tương ứng củ AUC và Cmin là 25% và 26% so với atanazavir/ritonavir 300/100mg).
Tenofovir được bài tiết qua thận bằng cả hai cách lọc ở cầu thận và bài tiết chủ động qua con đường vận chuyển anion hữu cơ 1 ở người (hOAT1). Dùng phối hợp tenofovir disoproxil funnarate với các thuốc khác cũng được bài tiết chủ động qua hệ thống vận chuyển anion hữu cơ (ví dụ như cidofovir) có thể làm tăng nồng độ của tenofovir hoặc của thuốc phối hợp.
Tenofovir disoproxil fumarate chưa được đánh giá ở những bệnh nhân đang dùng các thuốc gây độc thận (chẳng hạn như các aminoglycoside, amphotericin B, foscarnet, ganciclovir, pentanidine, vancomycin, cidofovir hoặc inter leukin – 2). Tránh sử dụng tenofovir disoproxil fumarate khi đang dùng hoặc mới ngừng dùng các thuốc gây độc thận. Nếu bắt buộc phải kết hợp tenofovir disoproxil fumarate với các thuốc gây độc thận, nên kiểm tra chức năng thận hàng tuần.
Bảo quản
Bảo quản khô mát, tránh ánh sáng, nhiệt độ dưới 30⁰C.