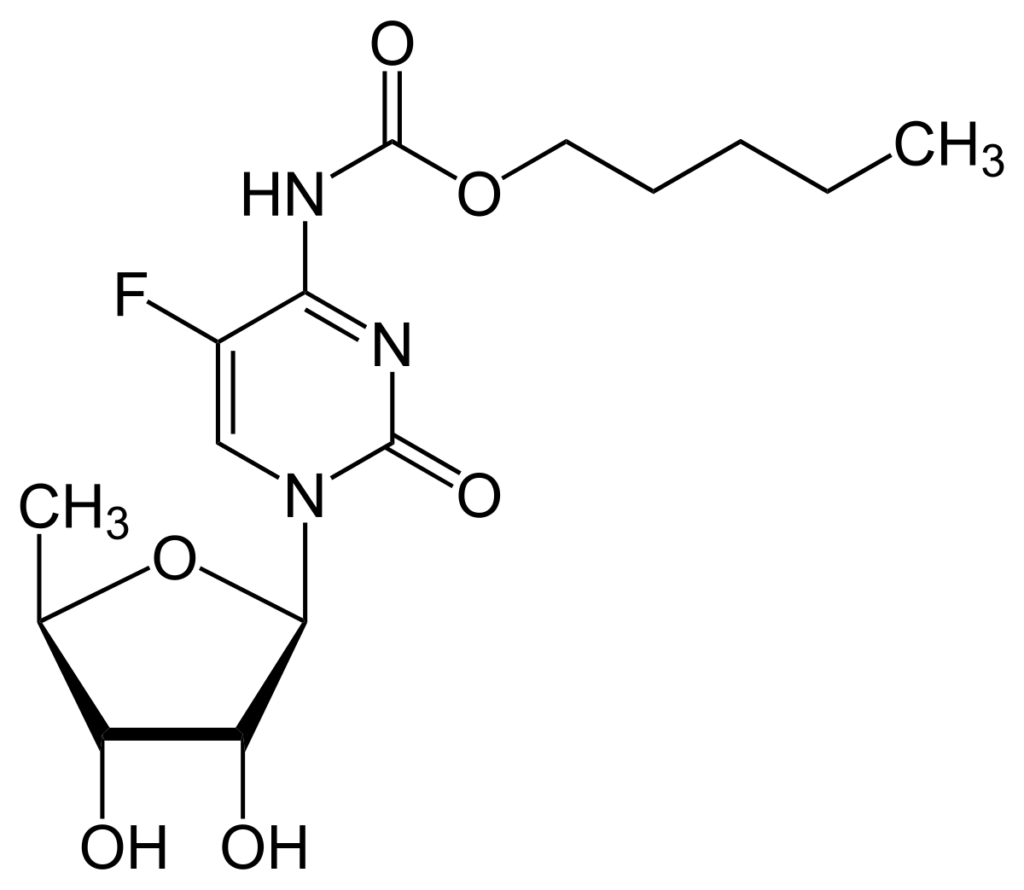
Tên chung quốc tế: Capecitabine
Mã ATC: L01BC06
Loại thuốc: Thuốc chống ung thư, tiền chất của fluorouracil
Dạng thuốc và hàm lượng
– Viên nén 150 mg; 500 mg.
Dược lý và cơ chế tác dụng
– Capecitabin hầu như không có tác dụng dược lý cho đến khi được chuyển thành fluorouracil (một thuốc chống chuyển hóa) bởi các enzym có nồng độ trong mô ung thư cao hơn nồng độ trong các mô xung quanh hay trong huyết tương. Capecitabin bị thủy phân ở gan thành 5’-deoxy-5-fluorouridin rồi thành 5-fluorouracil ở các mô. Người ta cho rằng nồng độ cao của thuốc có hoạt tính ở khối u khiến cho độc tính lên toàn thân ít đi. Ở tế bào lành và tế bào ung thư, fluorouracil được chuyển hóa thành 5-fluoro-2’-deoxyuridin 5’-monophosphat (FdUMP) và 5-fluorouridin triphosphat (FUTP). Cơ chế tác dụng của fluorouracil còn chưa hoàn toàn rõ nhưng cơ chế chính có lẽ do FdUMP (deoxyribonucleotid của thuốc) và đồng yếu tố folat gắn vào thymidylat synthase (TS) để tạo ra phức hợp bậc ba có dây nối đồng hóa trị là chất ức chế sự tạo thành thymidylat từ 2’-deoxyuridylat, do đó cản trở sự tổng hợp ADN. Ngoài ra, FUTP có thể gắn vào ARN thay cho uridin triphosphat, tạo ra ARN sai lạc nên ảnh hưởng lên sự tổng hợp protein. Fluorouracil tác động lên pha G1 và pha S của quá trình phân bào. Capecitabin có tác dụng lên các khối u ghép khác loài kháng fluorouracil; cho thấy có sự kháng chéo không hoàn toàn giữa hai thuốc này.
Dược động học
– Ít nhất 70% liều capecitabin uống vào được hấp thu ở ống tiêu hóa. Nồng độ đỉnh huyết tương capecitabin đạt sau khoảng 1,5 giờ còn nồng độ đỉnh của fluorouracil đạt đến sau 2 giờ. Có sự khác nhau rất lớn giữa các cá thể về nồng độ huyết tương và AUC. Thức ăn làm giảm tốc độ và mức hấp thu do đó làm giảm nồng độ huyết tương và AUC của các chất chuyển hóa của thuốc. Capecitabin hoặc các chất chuyển hóa được phân bố ở khối u, ở niêm mạc ruột, huyết tương, gan và các mô khác. Thực nghiệm trên súc vật cho thấy thuốc và các chất chuyển hóa không qua hàng rào máu – não; không rõ thuốc hoặc các chất chuyển hóa có vào trong dịch não – tủy và mô não ở người hay không. Nồng độ fluorouracil ở khối u cao hơn nồng độ ở các mô lành xung quanh, ở huyết tương hoặc ở các cơ. Tỷ lệ gắn vào protein huyết tương (chủ yếu là albumin) là dưới 60% và không phụ thuộc liều. Nghiên cứu trên người Nhật bản thấy với cùng liều uống, nồng độ đỉnh huyết tương của thuốc thấp hơn ở người da trắng và điều này chưa giải thích được.
– Capecitabin được chuyển hóa mạnh ở gan và ở khối u. Nửa đời thải trừ của capecitabin và các chất chuyển hóa (cả fluorouracil) khoảng 45 – 60 phút, trừ α-fluoro-β-alanin (chất giáng hóa của fluorouracil) có nửa đời ban đầu là 3 giờ.
– Thuốc được thải trừ chủ yếu qua nước tiểu (95,5% dưới dạng các chất chuyển hóa, khoảng 3% dưới dạng không thay đổi); chỉ có khoảng 2,6% được bài tiết qua phân.
Chỉ định
– Ung thư vú di căn không đáp ứng với trị liệu bằng anthracyclin hoặc tái phát trong khi trị liệu hoặc sau trị liệu bằng anthracyclin. Kết hợp với docetaxel để gây hiệp đồng tác dụng: docetaxel làm tăng enzym có nhiều ở khối u chuyển capecitabin thành fluorouracil.
– Đơn trị liệu để điều trị ung thư vú khu trú tại chỗ hoặc đã di căn giai đoạn cuối ở bệnh nhân kháng cả paclitacel, cả phác đồ hóa trị liệu có anthracyclin hay ở bệnh nhân kháng paclitacel nhưng không dùng thêm được anthracyclin (như người đã dùng tới liều tích lũy 400 mg/m2 doxorubicin hoặc thuốc tương đương doxorubicin).Dùng một mình hoặc để hỗ trợ điều trị sau khi cắt bỏ khối u nguyên phát ung thư đại tràng giai đoạn III (giai đoạn C theo phân loại Duke) khi thấy điều trị bằng một fluoropyrimidin tốt hơn. Có thể dùng capecitabin đơn độc thay thế cho fluorouracil/leucovorin cho người bị cắt u hoàn toàn lần đầu.
-Capecitabin là thuốc được lựa chọn hàng 1 để điều trị ung thư đại – trực tràng di căn khi thấy đơn trị liệu bằng một fluoropyrimidin tốt hơn.
Chống chỉ định
– Quá mẫn với capecitabin, fluorouracil hoặc với bất kỳ thành phần nào của thuốc.
– Bị thiếu hụt dihydropyrimidin dehydrogenase (DPD). Suy thận nặng (Clcr< 30 ml/phút).
– Giảm bạch cầu, giảm bạch cầu trung tính hoặc giảm tiểu cầu nặng.
– Đang dùng sorivudin hoặc các thuốc tương tự như brivudin.
Thận trọng
– Capecitabin phải được dùng dưới sự giám sát của thầy thuốc chuyên khoa có kinh nghiệm trong điều trị bằng các thuốc chống ung thư.
– Phải thông báo cho bệnh nhân và gia đình biết về những tai biến có hại của capecitabin, đặc biệt là buồn nôn, nôn, ỉa chảy, hội chứng bàn tay – bàn chân. Ngoài ra, người bệnh cần biết cần phải điều chỉnh liều trong khi điều trị bằng capecitabin.
– Cần thông báo cho bác sĩ biết khi thấy: đại tiện ban đêm hoặc đại tiện tăng tới 4 – 6 lần một ngày hoặc nhiều hơn, buồn nôn kèm chán ăn, nôn 2 – 5 lần một ngày hoặc nhiều hơn, bàn chân bàn tay phù đỏ và đau, mồm đau, phù, sốt v.v… Phải ngừng thuốc và thông báo ngay cho thầy thuốc biết.
– Thận trọng khi dùng cho người cao tuổi (≥ 80 tuổi) vì tăng nguy cơ bị ADR nặng. Nếu dùng phải giám sát chặt chẽ.
– Phải thận trọng khi dùng cho người bị suy gan nhẹ tới vừa do bị di căn vào gan. Phải giám sát thường xuyên chức năng gan trong quá trình điều trị. Chưa có dữ liệu về thuốc ở người bị suy gan nặng. Phải thận trọng khi dùng capecitabin cho người bị suy thận vừa (Clcr 30 – 50 ml/phút tính theo công thức Cockroft-Gault); phải giảm liều. Phải ngừng thuốc nếu thấy bị tác dụng phụ mức độ 2, 3, 4.
– Phải giám sát cẩn thận khi dùng ở người bệnh có tiền sử bệnh mạch vành vì tác dụng có hại lên tim mạch đã xảy ra khi dùng pirymidin flour hóa.
– Nếu dùng capecitabin cho người bệnh đang dùng thuốc chống đông máu coumarin thì phải thường xuyên xác định thời gian prothrombin hoặc thời gian đông máu để điều chỉnh liều thuốc chống đông máu.
– Capecitabin có thể gây chóng mặt, mệt mỏi và buồn nôn; bệnh nhân dùng thuốc này cần thận trọng khi lái xe hoặc vận hành máy.
Thời kỳ mang thai
– Chưa rõ capecitabin và các chất chuyển hóa có qua nhau thai hay không.
– Không dùng cho phụ nữ mang thai. Cần báo cho bệnh nhân trong tuổi sinh đẻ tránh mang thai trong thời gian điều trị bằng capecitabin. Nếu mang thai trong thời gian trị liệu phải giải thích cho bệnh nhân rõ các nguy cơ đối với thai.
Thời kỳ cho con bú
– Không rõ capecitabin và các chất chuyển hóa có qua sữa hay không. Thực nghiệm trên chuột cho thấy capecitabin và các chất chuyển hóa có nhiều trong sữa chuột mẹ. Nếu dùng capecitabin thì phải ngừng cho con bú.
Tác dụng không mong muốn (ADR)
– Rất thường gặp, ADR > 10/100
– Tim – mạch: Phù
– TKTW: Mệt mỏi, sốt, đau.
– Da: Hội chứng tay – bàn chân (phụ thuộc liều), viêm da.
– Tiêu hóa: Ỉa chảy (phụ thuộc liều), buồn nôn, nôn, đau bụng, viêm miệng, giảm thèm ăn, chán ăn, táo bón.
– Huyết học: Giảm bạch cầu, thiếu máu, giảm bạch cầu trung tính, giảm tiểu cầu.
– Gan: Tăng bilirubin. Cơ – xương: Loạn cảm. Mắt: Kích ứng mắt.
– Hô hấp: Khó thở.
– 5/100 <ADR < 10/100
– Tim – mạch: Tắc tĩnh mạch, đau ngực.
– TKTW: Nhức đầu, ngủ vùi, chóng mặt, mất ngủ, rối loạn tâm trạng, trầm cảm.
– Da: Bong móng, mẩn đỏ, mất màu da, rụng tóc, ban đỏ. Nội tiết – chuyển hóa: Mất nước.
– Tiêu hóa: Rối loạn nhu động, khô miệng, khó tiêu, viêm đường tiêu hóa trên (ung thư đại trực tràng), chảy máu, viêm ruột non, rối loạn vị giác.
– Cơ – xương: Đau lưng, mỏi cơ, đau cơ, đau khớp, đau chi dưới, bệnh thần kinh.
– Mắt: Rối loạn thị giác, viêm kết mạc. Hô hấp: Ho.
– Khác: Nhiễm virus.
– ADR < 5/100
– Đau thắt ngực, cổ chướng, hen, rung nhĩ, nhịp tim chậm, viêm phế quản, viêm phổi – phế quản, co thắt phế quản, suy kiệt, ngừng tim, suy tim, bệnh cơ tim, tai biến mạch não, ứ mật, rối loạn đông máu, viêm đại tràng, tắc tĩnh mạch sâu, toát mồ hôi, viêm tá tràng, khó nuốt, loạn nhịp tim, thay đổi điện tâm đồ, bệnh về não, chảy máu cam, nhiễm nấm, loét dạ dày, viêm dạ dày – ruột, ỉa ra máu, ho ra máu, suy gan, xơ gan, viêm gan, hạ kali huyết, hạ magnesi huyết, tăng hoặc giảm huyết áp, quá mẫn, tăng triglycerid huyết, ban xuất huyết do hạ tiểu cầu, liệt ruột, nhiễm khuẩn, tắc ruột, viêm kết mạc – giác mạc, tắc hẹp ống lệ, giảm bạch cầu, mất ý thức, phù bạch huyết, viêm đa ổ chất trắng trong não, thiếu máu cơ tim, tắc ruột hoại tử, nhiễm candida ở miệng, tràn dịch màng ngoài tim, ban xuất huyết do giảm tiểu cầu, giảm các tế bào máu, phản ứng với ánh sáng, viêm phổi, ngứa, tắc động mạch phổi, hội chứng phản ứng da sau chiếu xạ, suy thận, suy hô hấp, tăng tiết mồ hôi, nhiễm khuẩn huyết, loét da, nhịp tim nhanh, viêm tắc tĩnh mạch, giãn phì đại trực tràng, run đầu chi, ngoại tâm thu thất.
Hướng dẫn cách xử trí ADR
– Đa số các ADR của capecitabin là hồi phục được và không cần phải ngừng thuốc. Nếu bị nặng thì phải giảm liều (xem bảng hướng dẫn điều chỉnh liều theo mức độ bị độc).
– Hay gặp rối loạn tiêu hóa khi dùng capecitabin, nhất là ở người cao tuổi. Có thể dùng các thuốc chống ỉa chảy thông thường như loperamid. Phải bồi phụ nước và điện giải nếu bị ỉa chảy nặng, mất nước. Dùng thuốc chống nôn nếu bị nôn.
– Phải kiểm tra huyết học trước khi dùng capecitabin. Nếu thấy bạch cầu trung tính giảm (< 1,5 x 109/lít) và/hoặc tiểu cầu giảm (< 100 x 109/lít) thì không được dùng capecitabin. Trong khi điều trị, nếu thấy bạch cầu trung tính giảm (< 1,0 x 109/lít) và/hoặc tiểu cầu giảm (< 75 x 109/lít) thì phải ngừng thuốc. Nếu có suy tủy: Có thể dùng các yếu tố kích thích tạo máu như filgrastim, sargramostim, truyền máu, truyền tiểu cầu… Bệnh nhân bị giảm bạch cầu trung tính nặng phải được cách ly để tránh nhiễm khuẩn. Có thể phải truyền tủy cho người bị suy tủy nặng. Phải phòng giảm bạch cầu trung tính ở người có nguy cơ cao.
– Sốt có giảm bạch cầu trung tính: Phải cấy máu và dùng kháng sinh đường tĩnh mạch với người có nguy cơ cao, dùng theo đường uống với người có nguy cơ thấp.
– Giám sát chặt chẽ chức năng gan, nhất là ở người bị di căn ở gan vì có nguy cơ tăng bilirubin huyết nghiêm trọng.
– Phải thường xuyên theo dõi điện tâm đồ, nhất là ở người có tiền sử bệnh mạch vành để phòng nhồi máu cơ tim, thiếu máu cục bộ cơ tim, cơn đau thắt ngực, loạn nhịp, ngừng tim, đột tử.
– Viêm miệng: Rửa, xúc miệng bằng nước muối, bicarbonat. Nếu bị đau thì có thể dùng thuốc giảm đau tại chỗ; nếu đau nặng thì dùng thuốc giảm đau toàn thân. Chú ý dùng các thuốc có tác dụng tại chỗ để phòng nhiễm nấm và nhiễm khuẩn miệng.
– Phải đi khám mắt nếu thấy thị lực giảm hoặc có các triệu chứng nặng ở mắt trong quá trình dùng capecitabin.
– Điều trị các biểu hiện ngộ độc khác tùy theo biểu hiện và mức độ biểu hiện.
Liều lượng và cách dùng
– Uống thuốc cùng với nước, ngày 2 lần (sáng và chiều tối); khoảng 30 phút sau bữa ăn.
– Nếu dùng đồng thời với docetaxel, bệnh nhân cần uống capecitabin trước.
Điều trị ung thư vú:
– Trị liệu kết hợp với docetacel: Liều capecitabin ban đầu là 1 250 mg/m2, ngày 2 lần (2 500 mg/m2/ngày) trong 2 tuần; sau đó nghỉ dùng 1 tuần. Đợt trị liệu theo chu kỳ 3 tuần. Trị liệu kéo dài ít nhất 6 tuần. Sau liều ban đầu, điều chỉnh các liều tiếp theo tùy theo dung nạp thuốc của bệnh nhân và theo dõi chặt chẽ để có được đáp ứng điều trị tối ưu với tác dụng độc ít nhất. Docetacel liều 75 mg/m2 truyền tĩnh mạch trong 1 giờ sau capecitabin vào ngày đầu của chu kỳ 3 tuần. Phác đồ điều trị phối hợp được tiếp tục ít nhất 6 tuần. Đơn trị liệu: Liều ban đầu là 1 250 mg/m2, ngày 2 lần (2 500 mg/ m2/ngày) trong 2 tuần; sau đó nghỉ dùng 1 tuần. Đợt trị liệu theo chu kỳ 3 tuần. Một số chuyên gia khuyên nên dùng trong 2 chu kỳ (6 tuần) để đánh giá đáp ứng. Trong thử nghiệm, có thể thấy đáp ứng lâm sàng trong vòng 6 – 12 tuần. Sau liều ban đầu, điều chỉnh liều tiếp theo tùy theo dung nạp thuốc của bệnh nhân và theo dõi chặt chẽ để có được đáp ứng điều trị tối ưu với tác dụng độc ít nhất.
Điều trị ung thư đại tràng:
– Điều trị hỗ trợ trong ung thư đại tràng: Liều ban đầu là 1 250mg/ m2 ngày 2 lần (2 500 mg/m2/ngày) trong 2 tuần; sau đó nghỉ dùng 1 tuần. Đợt trị liệu theo chu kỳ 3 tuần. Tổng số chu kỳ điều trị là 8 chu kỳ và thời gian điều trị là 6 tháng. Sau liều ban đầu,điều chỉnh liều tiếp theo tùy theo dung nạp thuốc của bệnh nhân và theo dõi chặt chẽ để có được đáp ứng điều trị tối ưu với tác dụng độc ít nhất. Lựa chọn hàng đầu cho ung thư đại trực tràng di căn: Liều capecitabin ban đầu là 1 250 mg/m2, ngày 2 lần (2 500 mg/m2/ ngày) trong 2 tuần; sau đó nghỉ dùng 1 tuần. Đợt trị liệu theo chu kỳ 3 tuần. Sau liều ban đầu, điều chỉnh liều tiếp theo tùy theo dung nạp thuốc của bệnh nhân và theo dõi chặt chẽ để có được đáp ứng điều trị tối ưu với tác dụng độc ít nhất.
Điều chỉnh liều căn cứ theo:
– Diện tích thân thể (Bảng 1).
– Tuổi: Một số nhà lâm sàng khuyến cáo phải giảm liều capecitabin ban đầu tới 20% ở người ≥ 80 tuổi nếu dùng capecitabin đơn độc. Khi dùng capecitabin phối hợp với docetacel để điều trị ung thư vú cho người bệnh ≥ 60 tuổi thì liều capecitabin ban đầu phải giảm 25% (tới 950 mg/m2).
– Độc tính và mức độ độc tính (Bảng 2), mức độ bị độc và sự mắc lại các độc tính của thuốc khi dùng capecitabin đơn độc (Bảng 2, Bảng 4) hoặc dùng kết hợp với docetacel (Bảng 3).
– Khi trị liệu bị ngưng do độc tính thì dùng thuốc tiếp tục theo các chu kỳ điều trị đã đề ra, không thay thế các liều bị bỏ do độc tính. Một khi đã giảm liều do độc tính thì sau này không được tăng liều lên nữa. Nếu trong một đợt điều trị, người bệnh không bị độc tính hoặc bị độc ở mức độ 1 thì duy trì liều này ở các đợt tiếp theo cho đến khi có biểu hiện bị độc nặng hơn.
Các bảng dưới đây hướng dẫn chi tiết cách tính liều và điều chỉnh liều:
– Liều ban đầu khuyên dùng theo diện tích thân thể: 1 250 mg/m2/lần; ngày 2 lần. Liều 1 ngày trong bảng dưới đây phải được chia làm 2 liều bằng nhau.
– Diện tích thân thể (m2) Liều 1 ngày (mg)
≤ 1,25 3 000
1,26 – 1,37 3 300
1,38 – 1,51 3 600
1,52 – 1,65 4 000
1,66 – 1,77 4 300
1,78 – 1,91 4 600
1,92 – 2,05 5 000
2,06 – 2,17 5 300
≥ 2,18 5 600
– Không cần thiết phải điều chỉnh liều ở người bị suy gan nhẹ và vừa. Người bị suy thận: Không cần giảm liều ở người bị suy thận nhẹ; giảm 25% liều ban đầu (còn 950 mg/m2; ngày 2 lần) nếu bị suy thận vừa. Theo dõi chặt chẽ bệnh nhân bị suy thận nhẹ hoặc vừa để phòng tăng ADR.
– Người cao tuổi: Có thể phải giảm liều tới 20% – 25%.
– Chỉ tiêu phân mức độ ngộ độc hay xảy ra với capecitabin (trừ hội chứng tay – chân) theo Viện ung thư quốc gia Canada (NCIC).
– Tê, rối loạn/giảm cảm giác, ngứa, sưng không đau, đỏ bàn tay và/hoặc bàn chân gây khó chịu nhưng vẫn hoạt động bình thường được trong cuộc sống hàng ngày.
– Da bàn tay và/ hoặc bàn chân đỏ, đau, sưng ảnh hưởng lên hoạt động sống bình thường hàng ngày.
– Hội chứng bàn tay – bàn chân)
– Da ướt, bị bong, loét, phồng rộp, đau nhiều ở bàn tay và/hoặc bàn chân, không làm được các việc bình thường trong cuộc sống hàng ngày.
Số lượng bạch cầu lympho 1 500 – 1 999/mm3
Số lượng bạch cầu lympho 1 000 – 1 499/mm3
Số lượng bạch cầu lympho 500 – 999/mm3
Số lượng bạch cầu lympho < 500/mm3
Bảng 3. Điều chỉnh liều do độc tính trong trị liệu với capecitabin và docetaxel.
Mức độ theo NCIC Mức 2 Mức 3 Mức 4
Xuất hiện lần đầu
Trong quá trình điều trị
Điều chỉnh liều cho chu kỳ tiếp theo
Ngừng thuốc cho đến khi về mức 0 hoặc 1.
Trở lại trị liệu với 100% liều capecitabin lúc trước; không thay các liều đã thiếu.
Nếu vẫn còn bị độc thì đợi đến khi trở về mức 0 -1.
Bắt đầu chu kỳ tiếp theo với liều bằng 100% liều capecitabin và docetaxel ban đầu.
Ngừng thuốc cho đến khi về mức 0 hoặc 1.
Trở lại trị liệu với 100% liều capecitabin lúc trước; không thay các liều đã thiếu.
Nếu vẫn còn bị độc thì đợi đến khi trở về mức 0 -1.
Bắt đầu chu kỳ tiếp theo với liều capecitabin bằng 75% liều ban đầu và docetaxel 55 mg/m2.
Ngừng hẳn trị liệu hoặc
nếu bắt buộc phải tiếp tục trị liệu vì lợi ích cho bệnh nhân thì đợi cho đến khi về mức 0-1 thì điều trị tiếp với liều bằng 50% liều đã dùng.
Các biểu hiện bị độc như lần trước xuất hiện lần 2
Trong quá trình điều trị
Điều chỉnh liều cho đợt tiếp theo
Ngừng điều trị cho đến khi trở về mức 0 – 1.
Tiếp tục điều trị với liều capecitabin bằng 75% liều ban đầu; không thay thế các liều đã thiếu.
Nếu vẫn còn bị độc thì đợi đến khi trở về mức 0 -1.
Bắt đầu chu kỳ mới với capecitabin bằng 75% liều ban đầu và liều
docetaxel 55 mg/m2
Ngừng điều trị cho đến khi trở về mức 0 – 1. Tiếp tục điều trị với liều capecitabin bằng 50% liều ban đầu; không thay thế các liều đã thiếu.
Nếu vẫn còn bị độc thì đợi đến khi trở về mức 0 -1.
Bắt đầu chu kỳ mới với capecitabin bằng 50% liều ban đầu và ngừng dùng docetaxel.
Ngừng hẳn trị liệu.
Các biểu hiện bị độc như lần trước xuất hiện lần 3
Trong quá trình điều trị
Điều chỉnh liều cho đợt tiếp theo
Ngừng điều trị cho đến khi trở về mức 0 – 1.
Tiếp tục điều trị với capecitabin bằng 50% liều ban đầu; không thay thế các liều đã thiếu.
Nếu còn bị độc, ngừng điều trị cho đến khi trở về mức 0 – 1.
Bắt đầu chu kỳ tiếp theo với capecitabin bằng 50% liều ban đầu và ngừng dùng docetaxel.
Ngừng hẳn trị liệu.
Các biểu hiện bị độc như lần trước xuất hiện lần 4 Ngừng hẳn trị liệu.
– Chú ý: Bao giờ cũng phải thực hiện các biện pháp phòng ngừa độc tính của thuốc nếu có thể. Mọi thay đổi về liều lượng phải căn cứ vào mức bị độc nặng nhất trước đấy.
– Bảng 4. Điều chỉnh liều do độc tính của capecitabin trong đơn trị liệu.
Mức độ độc Số lần bị độc Trong quá trình dùng thuốc Liều cho chu kỳ tiếp
(% của liều ban đầu)
Mức 1 Không có
biểu hiện
Duy trì liều Duy trì liều
– Ngừng thuốc cho đến khi về mức 0 – 1. Ngừng thuốc cho đến khi về mức 0 – 1. Ngừng thuốc cho đến khi về mức 0 – 1. Ngừng hẳn dùng thuốc.
100%
75%
50%
Mức 3
Lần 1
Lần 2
Lần 3
– Ngừng thuốc cho đến khi về mức 0 – 1. Ngừng thuốc cho đến khi về mức 0 – 1. Ngừng hẳn dùng thuốc. 75%
50%
Mức 4
Lần 1
– Ngừng hẳn dùng thuốc hoặc nếu bắt buộc phải tiếp tục trị liệu vì lợi ích cho người bệnh thì đợi cho đến khi về mức 0 – 1
50%
Chú ý: Mọi thay đổi về liều lượng phải căn cứ vào mức bị độc nặng nhất đã bị trước đấy.
Tương tác thuốc
– Không dùng đồng thời capecitabin với natalizumab, vắc xin sống. Capecitabin làm tăng nồng độ hoặc tác dụng của: Các cơ chất của CYP2C9, natalizumab, phenytoin, vắc xin sống, thuốc kháng vitamin K. Cần theo dõi các chỉ số về đông máu khi dùng đồng thời capecitabin và thuốc chống đông coumarin và có thể phải giảm liều thuốc chống đông. Cần kiểm soát nồng độ phenytoin ở người dùng đồng thời capecitabin và phenytoin.
– Capecitabin làm giảm nồng độ hoặc tác dụng của các vắc xin bất hoạt. Acid folinic làm tăng độc tính của capecitabin; phải giảm liều capecitabin (liều tối đa chỉ là 2 000 mg/m2 chứ không phải là 3 000 mg/m2) khi dùng đồng thời với acid folinic.
– Sovuridin và các chất cùng họ như brivudin làm tăng độc tính của fluoropyrimidin lên mức nguy hiểm. Chỉ bắt đầu dùng capecitabin ít nhất là 4 tuần sau khi đã ngừng dùng các thuốc này.
– Các thuốc kháng acid làm tăng nồng độ capecitabin và chất chuyển hóa 5’-deoxy-5-fluorocytidin (5’-DFCR). Uống các thuốc chống acid ít nhất là 2 giờ sau khi uống capecitabin.
– Alopurinol làm giảm tác dụng của 5-fluorouracil (5-FU). Tránh dùng đồng thời capecitabin và alopurinol.
– Liều capecitabin tối đa khi dùng đồng thời interferon alpha-2a (3 MUI/m2/ngày) là 2 000 mg/ngày chứ không phải là 3 000 mg/ ngày như khi được dùng một mình.
– Nếu kết hợp với xạ trị ung thư trực tràng, liều tối đa capecitabin là 2 000 mg/ngày, dùng theo phác đồ liên tục hoặc dùng hàng ngày từ thứ 2 đến thứ 6 trong đợt xạ trị kéo dài 6 tuần.
– Leucovorin, levoleucovorin, trastuzumab làm tăng nồng độ hoặc tác dụng của capecitabin.
– Echinacea làm giảm nồng độ hoặc tác dụng của capecitabin.
Độ ổn định và bảo quản
– Bảo quản viên nén capecitabin trong lọ kín ở nhiệt độ 15 – 30 °C. Nếu được để trong lọ kín ở nhiệt độ phòng thì thuốc ổn định trong ít nhất là 9 tháng.
Quá liều và xử trí
– Các triệu chứng quá liều là buồn nôn, nôn, ỉa chảy, kích thích và chảy máu ống tiêu hóa, suy tủy. Bệnh nhân dùng 1 657 mg/m2/ngày (chia làm 2 lần) trong 6 tuần bị hội chứng bàn tay – bàn chân (lòng bàn tay, lòng bàn chân bị đỏ và giảm cảm giác), viêm niêm mạc và ỉa chảy.
– Không có thuốc đặc trị quá liều capecitabin. Xử trí quá liều chủ yếu là tạm ngừng dùng thuốc và tiến hành các biện pháp hỗ trợ thích hợp với biểu hiện ngộ độc. Lọc máu có thể lấy bớt 5’-deoxy-5- fluorouridin (DFUR) là chất chuyển hóa có phân tử lượng thấp của capecitabin. Từ tháng 5 năm 2009, FDA Hoa kỳ coi uridin triacetat (còn được gọi là vistonuridin), một tiền chất của uridin, là chất giải độc fluorouracil, liều dùng ở người lớn là 10 g, 6 giờ một lần, dùng 20 liều ngay sau khi bị ngộ độc 5 – FU. Tuy không có dữ liệu về tác dụng của uridin triacetat đối với ngộ độc capecitabin nhưng người ta cho rằng có thể có tác dụng.
Thông tin qui chế
– Capecitabincó trong Danh mục thuốc thuốc tân dược thuộc phạm vi thanh toán của quỹ bảo hiểm y tế, năm 2015.
Tên thương mại
– Capebina; Capemax; Relotabin; Xeloda.